WAS SIE ÜBER PHARMAZEUTISCHE WASSERSYSTEME WISSEN MÜSSEN
ccs
Und über BWT-Lösungen für Ihre Kontaminationskontrollstrategie.
Mit der Veröffentlichung von Annex 1 des EU-GMP-Leitfadens im August 2022 ist die Implementierung einer Kontaminationskontrollstrategie (Contamination Control Strategy, CCS) obligatorisch geworden. Auch der Umfang der CCS hat sich geändert. Sie schließt nunmehr nicht nur die Prüfung des Endprodukts auf die freigaberelevanten Parameter wie Leitfähigkeit, TOC-Wert und Bioburden ein, sondern auch die Überwachung des gesamten Prozesses. Auf der Grundlage eines Kontaminationsrisikomanagements (Contamination Risk Management, CRM) müssen Maßnahmen und Aktivitäten umgesetzt werden, mit denen die vorgegebenen Funktionen jedes einzelnen Prozessschrittes der Wasserreinigungsanlage gewährleistet werden, insbesondere bei Kaltwasseranlagen.


Mit BWT-Lösungen sind Sie auf die Umsetzung einer CCS vorbereitet.
Wir stehen Ihnen zur Seite.
CCS: Ein ganzheitliches Konzept
Im Annex 1 des EU-GMP-Leitfadens heißt es: „...Angemessenes Design der Anlage, der Ausrüstung und der Prozesse, gefolgt von der Umsetzung gut durchdachter Verfahren und schließlich der Anwendung von Überwachungssystemen als das Element, mit dem nachgewiesen wird, dass das Design und die Verfahren korrekt umgesetzt wurden und weiterhin den Erwartungen entsprechen...“
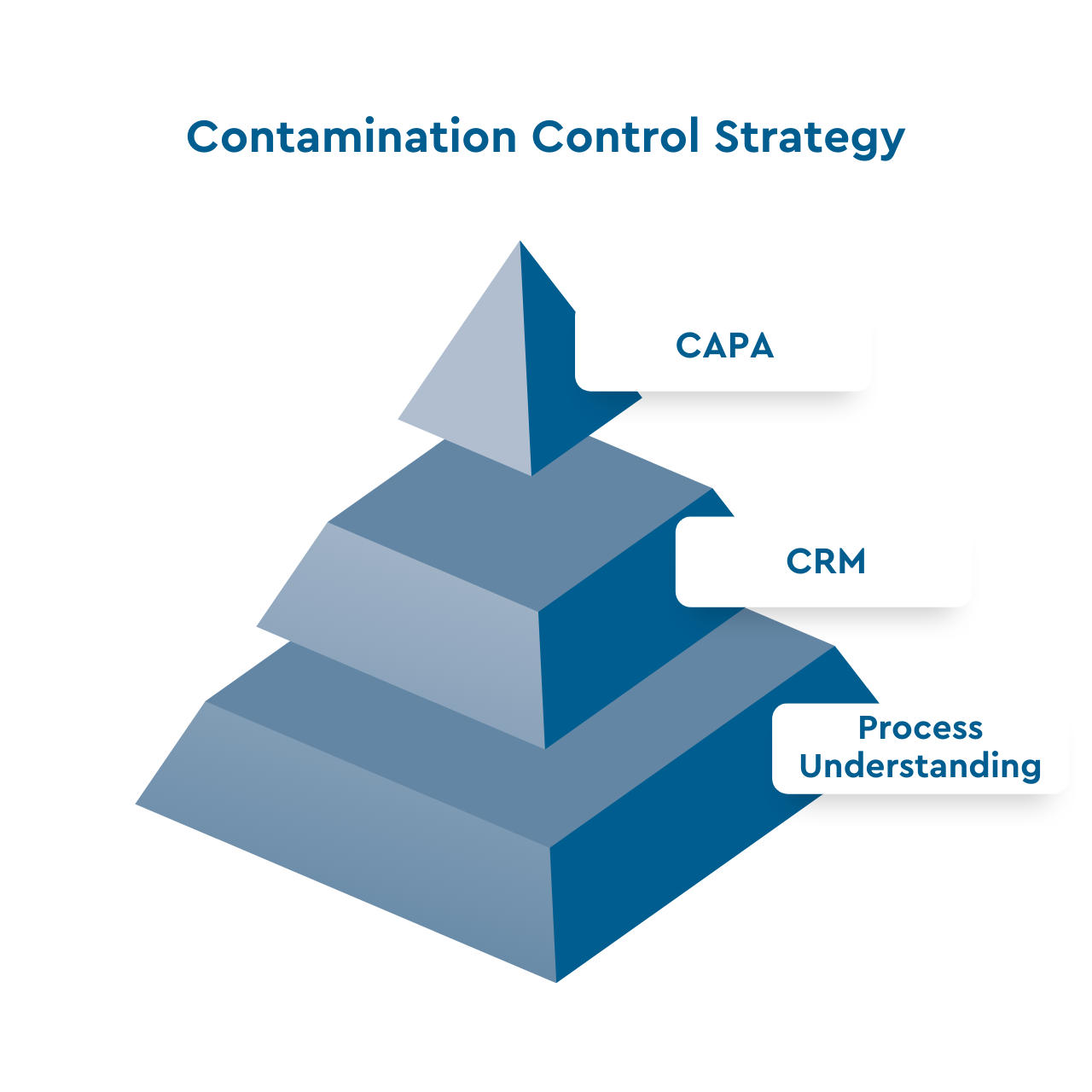

Der CCS kann in vier Elemente unterteilt werden:
Kontaminationsrisikomanagement
Grundlage einer erfolgreichen Kontaminationskontrollstrategie ist ein Kontaminationsrisikomanagement (CRM), das ein tiefes Verständnis der einzelnen Prozessschritte und ihres jeweiligen Beitrags zum Kontaminationsrisiko erfordert. Auf der Grundlage des CRM, das erforderlich ist, um alle Risiken in Ihrem Wassersystem zu identifizieren, kann eine CCS umgesetzt werden.
Die vier Hauptelemente der CCS
Prävention
Die Prävention einer mikrobiellen Kontamination ist bei der Wassererzeugung für die pharmazeutische Industrie entscheidend. Aber wie können wir diese dauerhaft vermeiden? Indem wir den Prozess verstehen und somit in der Lage sind, den Beitrag zum Risiko einer mikrobiellen Kontamination für jeden einzelnen Prozessschritt abzuschätzen.
Das Design der Anlage und die Wartungsverfahren sind hierbei die beiden entscheidenden Aspekte. Wir müssen verstehen, woher die Keime kommen. Daher ist es entscheidend zu wissen, wie der gesamte Prozess der Wassererzeugung aufgebaut ist.



Kontrolle
Die heterotrophe Keimzahl (Heterotrophic Plate Count, HPC) ist derzeit die einzige anerkannte Methode zur Überwachung der mikrobiellen Kontamination. Ein ernsthaftes Problem bei der Umsetzung einer CCS, wie in Annex I beschrieben, ist die Tatsache, dass mit der HPC nicht alle Mikroorganismen in einer Probe nachgewiesen werden können. Denn dabei werden nur koloniebildende Einheiten (KBE) sichtbar.
Studien haben gezeigt, dass die Anzahl der KBE keineswegs die Anzahl der Mikroorganismen in einem System widerspiegelt. Um die tatsächliche mikrobielle Situation in einem Wasserreinigungssystem zu erfassen, müssen Schnellmethoden in Betracht gezogen werden, um eine bessere Kontrolle zu erhalten.
Bekämpfung
Es gibt kein Erzeugungs- und -verteilungssystem für PW- oder WFI-Wasser, das über den gesamten Lebenszyklus hinweg steril ist. Mikroorganismen finden immer einen Weg in die Anlage. Entweder über das Rohwasser, durch Rückkontamination an den Entnahmestellen oder bei Wartungsarbeiten. Sterilität ist technisch schwer zu erreichen und würde einen hohen Aufwand und hohe Kosten verursachen, und die Sterilisationsverfahren stellen eine enorme Belastung für die Ausrüstung dar.




Dokumentation
Ein entscheidender Faktor für den Erfolg einer CCS ist eine lückenlose Dokumentation. Es reicht nicht mehr aus, nur von 21 CFR Part 11 oder Audit Trail zu sprechen. Vielmehr geht es um Daten, die während des Lebenszyklus des Systems generiert werden: Rohdaten, Metadaten und so weiter. Aufgrund der steigenden Anforderungen an das Datenmanagement und die Datenintegrität, z. B. durch das ALCOA- oder ALCOA+-Prinzip und andere Vorschriften, nimmt der Aufwand für eine rechtskonforme Dokumentation ständig zu. Eine beträchtliche Anzahl von Beschwerden und Abmahnungen der FDA steht im Zusammenhang mit Verstößen gegen die Datenintegrität.
Events
Bis bald!
Unexpected error. Please try to reload the page








