TOUT CE QUE VOUS DEVEZ SAVOIR SUR LES SYSTÈMES DE PRODUCTION D’EAU À USAGE PHARMACEUTIQUE
ccs
Et sur les solutions BWT concernant votre stratégie de contrôle des contaminations.
Avec la publication de l’annexe 1 des Bonnes pratiques de fabrication (BPF) de l’Union européenne au mois d’août 2022, la mise en œuvre d’une stratégie de contrôle des contaminations (CCS) est devenue obligatoire. La portée de la stratégie de contrôle des contaminations a également changé. Celle-ci n’inclut pas uniquement le test du produit final, en fonction de paramètres importants pour la publication, tels que la conductivité, le COT (carbone organique total) et la biocontamination, mais aussi le contrôle de l’ensemble du processus. Sur la base d’une gestion des risques de contamination (CRM, contamination risk management), des mesures et des activités doivent être mises en œuvre afin de garantir les fonctionnalités spécifiées de chaque étape du processus du système de purification d’eau, notamment les systèmes de production d’eau froide.


Avec les solutions BWT, vous êtes prêts pour la mise en œuvre d’une stratégie de contrôle des contaminations.
Nous sommes là pour vous aider.
Stratégie de contrôle des
contaminations: un concept global
Comme le stipule l’annexe I des BPF de l’Union européenne : « ... une conception appropriée de l’installation, de l’équipement et des processus, suivie de la mise en œuvre de procédures bien conçues, et enfin l’application de systèmes de surveillance comme élément démontrant que la conception et les procédures ont été correctement mises en place et qu’elles continuent à fonctionner conformément aux attentes... »
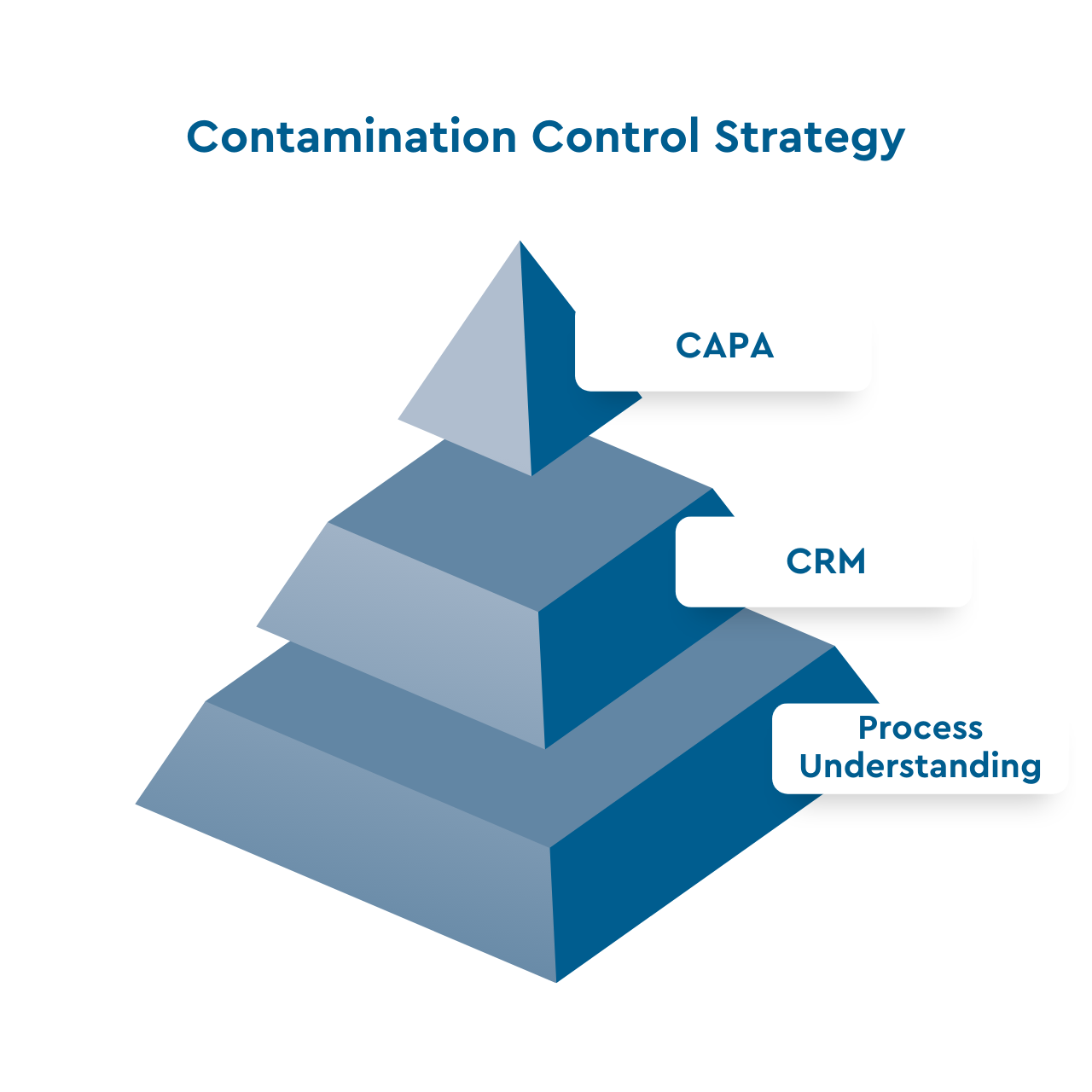

Le CCS peut être décomposé en quatre éléments
Contamination Risk Management
The foundation of a successful Contamination Control Strategy is a Contamination Risk Management (CRM) which requires a deep understanding of the individual process steps and their contribution to the contamination risk. Based on the CRM, which is required to identify all risks in your water system, a CCS can be implemented.Les quatre éléments principaux de la stratégie
de contrôle des contaminations
Prévention
La prévention d’une contamination microbienne est cruciale dans le cadre de la production d’eau destinée à l’industrie pharmaceutique. Mais comment pouvons-nous réaliser une prévention durable ? En comprenant le processus et en étant ainsi capable d’estimer la part du risque de contamination microbienne pour chaque étape du processus.
La conception de l’installation et les procédures de maintenance sont les deux aspects cruciaux. Nous devons comprendre d’où viennent les germes, et il est donc essentiel de savoir comment est structuré l’ensemble du processus de production d’eau.


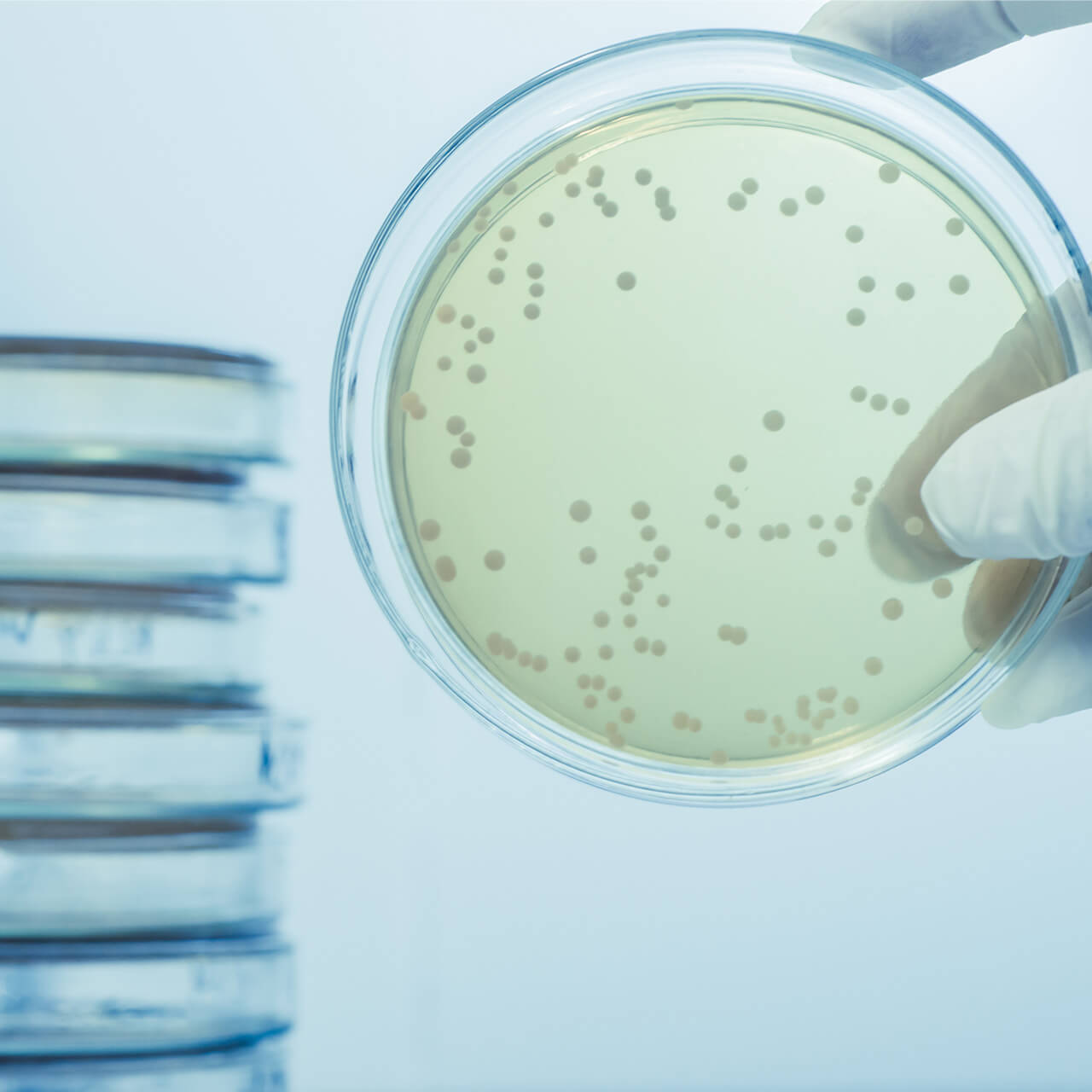

Contrôle
La numération des bactéries hétérotrophes (HPC, Heterotrophic Plate Count) est aujourd’hui la seule méthode officinale de contrôle des contaminations microbiennes. Le fait que la numération des bactéries hétérotrophes ne permette pas de détecter tous les micro-organismes présents dans un échantillon constitue un grave problème pour la mise en œuvre d’une stratégie de contrôle des contaminations comme décrit dans l’annexe I. Seules les unités formatrices de colonies (UFC) sont visibles.
Des études ont montré que le nombre d’UFC ne reflète pas le nombre de micro-organismes présents dans un système. Afin d’appréhender la situation microbienne réelle dans un système de purification d’eau, des méthodes rapides doivent être envisagées pour obtenir davantage de contrôle.
Lutte
Il n’existe pas de système de production et de distribution d’eau purifiée ou d’eau pour injection qui soit stérile tout au long de son cycle de vie. Les micro-organismes parviennent toujours à entrer dans l’installation. Soit par le biais de l’eau brute, soit par rétro-contamination à travers les points d’utilisation, soit au cours des activités de maintenance. Du point de vue technique, il est difficile d’obtenir la stérilité et cela nécessiterait un effort et des coûts importants. De même, les procédures de stérilisation exercent un stress énorme sur l’équipement.




Documentation
Un facteur clé de succès pour une stratégie de contrôle des contaminations est une documentation sans lacunes. Il ne suffit plus de parler de la partie 11 du CFR 21 (code des règlements fédéraux des États-Unis) ou de piste d’audit. On parle davantage de données générées au cours du cycle de vie du système, de données brutes, de métadonnées, etc. En raison des exigences croissantes en matière de gestion et d’intégrité des données, par exemple le principe ALCOA ou ALCOA+ et d’autres réglementations, l’effort pour une documentation conforme est en constante augmentation. De nombreuses préoccupations et lettres d’avertissement de la FDA (Food and Drug Administration : Agence américaine des produits alimentaires et des médicaments) sont liées à des violations de l’intégrité des données.
Events
See you soon!
Unexpected error. Please try to reload the page








